亚专科
亚专科
轻度创伤性脑损伤(mTBI)可引起自由基的异常生成,并与氧化应激、继发损伤信号级联、线粒体功能障碍和不良功能结局有关。以自由基为药理学靶点的抗氧化剂已作为验证过的治疗方法。来自美国弗吉尼亚理工大学的Bailey等人首次报道一种新型再生氧化铈纳米颗粒抗氧化剂,在体内外神经创伤模型中可减少神经元死亡和钙失调,保护内源性抗氧化系统,并改善认知功能。结果发表在2020年6月的《Journal of Neurotrauma》上。
DOI: 10.1089/neu.2016.4644
研究背景
轻度创伤性脑损伤(mTBI)的继发性损伤包括自由基的异常产生和增加的氧化应激。尽管有内源性大脑抗氧化剂如超氧化物歧化酶(SOD),过氧化氢酶,和谷胱甘肽(GSH),TBI后产生过多自由基超出了内源性防御限度,使大脑处于高氧化应激的异常状态,并持续进入慢性阶段。这种氧化应激的增加可造成认知能力的改变。传统抗氧化剂曾被用来试图减轻TBI的病理效应,但在临床试验中取得的成功有限。
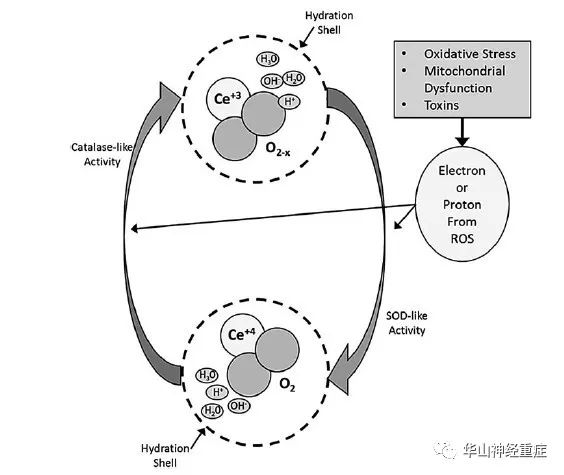
铈是镧系中的稀土元素,具有多重价态,介导氧化还原活动。氧化物的晶格结构由于电子“空穴”或纳米颗粒基质中的氧缺陷,氧化还原能力更强。此外,CeONP的自由基清除活性是在生物条件下是可再生的,允许持续活性的。研究表明CeONPs保存了脑细胞的生命周期,并保存正常的钙信号。CeONPs还能保护神经元和其他类型的细胞免受自由基的侵害刺激和减少炎症功能。
研究方法
CeONPs在柠檬酸盐缓冲液中重悬。使用大鼠(n = 6)采用单尾静脉注射确认纳米颗粒在大脑中的分布。从1-2日龄新生大鼠中制备神经元培养物并生长在硅橡胶底的组织培养板中,用94A细胞损伤控制器模型对细胞进行损伤。这些损伤已显示与人身上发生的旋转加速-减速伤有关。体外培养第12-14天, CeONP加入培养物。评估神经元损伤以碘化丙钠的摄取(PrI)测定,计数损伤细胞。[Ca2+]通过显微分光光度成像测定。
通过轻度横向液压冲击模型(mFPI)对成年雄性SD大鼠制造脑损伤。CeONP给药模式如下:伤后3小时内给药3次(3×)或伤后48小时内给药5次(5×)。3×组在伤后1min,15min,3h接受注射,5×组再在此基础上24h和48h接受注射。低剂量组为0.05μg/g(LD)和高剂量组为0.5g/g(HD),分别在每个注射模式中使用。因此研究共分4组:3×LD,3×HD,5×LD,5×HD。测定SOD酶,过氧化氢酶和已经氧化/还原的GSH量作为内源性抗氧化剂。通过脂质过氧化氢(LOOH)和3-硝基酪氨酸(NT)的形成来评估细胞大分子的氧化。
使用新对象识别测试(NOR)评估动物模型短期记忆缺陷。一只大鼠被置于80×80cm的测试场地,有2个相同的物体,探索5分钟。20分钟后,老鼠又回到了笼子里的测试场所,其中一个对象被替换为一个新的对象。计算每次花在探索新物体上的时间除以总时间。探索的新奇对象明显多于熟悉对象(评分>0.5)被定义为无记忆缺陷。统计使用two-way ANOVA分析和t检验,P值<0.05为有统计学意义。
研究结果
图1显示了透射电子显微镜(TEM)下的CeONP悬浮液,平均粒径为10nm,均匀,无团聚的混合物。CeONPs悬浮在柠檬酸盐溶液中到达大脑,浓度如图2所示,LD剂量的CeONPs在大脑的铈含量增加了3.6倍,HD剂量5.8倍。CeONPs不会在大脑中代谢,在给药后会累积长达6个月。CeONPs的剂量或10倍以上的剂量没有报道产生了不良反应。
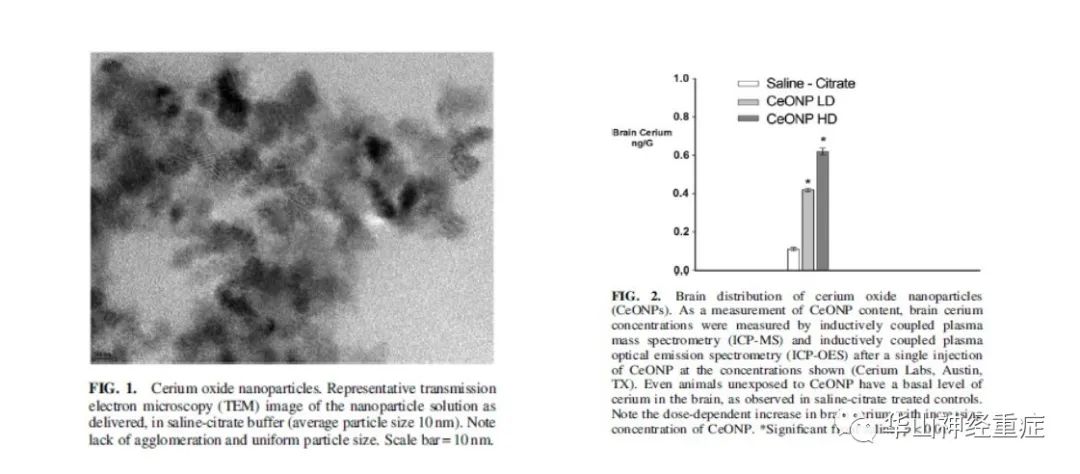
图1 氧化铈纳米颗粒。纳米颗粒柠檬酸盐溶液注射后代表性透射电子显微镜(TEM)图像(平均颗粒大小10nm)。注意到颗粒无团聚,大小均一。比例尺=10nm.
图2 氧化铈纳米颗粒在大脑中的分布(CeONPs)。作为CeONP含量的测定方法,脑铈含量使用电感耦合等离子体质谱(ICP-MS)和电感耦合等离子体发生光谱(ICP-OES)在单次注射CeONP测定显示的浓度(Cerium Labs, Austin, TX)。即使未接触CeONP的动物大脑中也有基础水平的的铈,在柠檬酸盐处理的对照组中可观察到。注意大脑中随着CeONP的浓度剂量依赖增加的铈。*与生理盐水组比显著差异,P<0.01。
碘化丙钠的摄取(PrI)实验显示,未损伤的培养细胞显示出微量PrI摄取(图3A)。轻度或中度损伤增加了24小时后PrI摄取。在细胞轻度损伤后1小时CeONPs处理时,PrI的吸收减少,其中CeONP以10nM为最有效剂量。在中度损伤水平,10nM CeONP使PrI摄取降低78%。1 μM CeONPs24小时降低了PrI摄取效果不如低剂量。
[Ca2+]i实验显示,未损伤的神经元受到100μM谷氨酸的刺激后产生[Ca2+]i的平均变化为203±12nM,(图3B)。轻度损伤24h或48 h后对谷氨酸的反应减少。中度损伤24小时后,神经元损伤对谷氨酸的反应显著增加,提示兴奋性毒性损伤的增加,在损伤后48小时,对谷氨酸的反应低于正常水平。CeONPs处理的细胞在轻度或中度体外损伤后24、48 h谷氨酸信号未出现畸变。这些结果表明,CeONPs能有效地抑制损伤损伤引起的异常谷氨酸信号,可保留外伤后的神经功能。
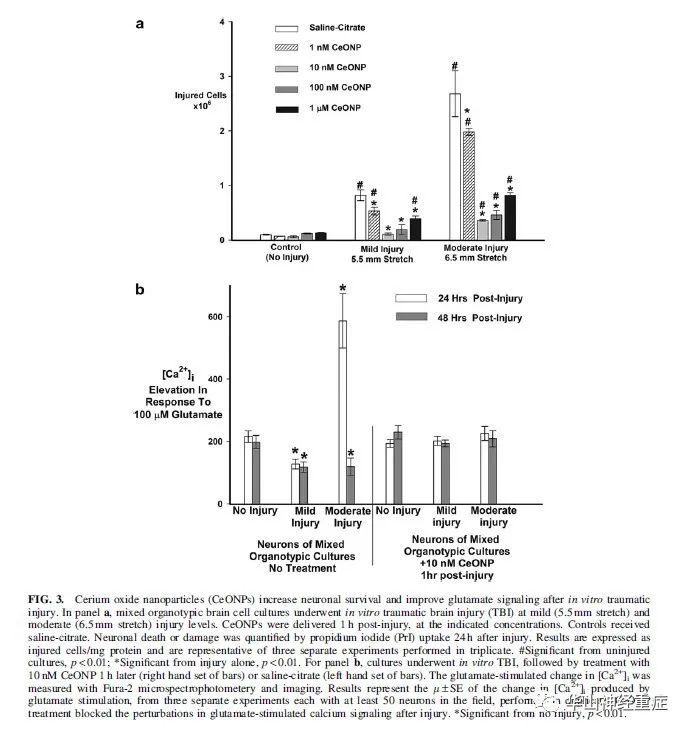
图3 氧化铈纳米颗粒(CeONPs)在体外创伤后增加神经细胞存活率和改善谷氨酸信号。图a中,混合器官型脑细胞培养在轻度(5.5mm拉伸)和中度(6.5mm拉伸)水平进行体外创伤性脑损伤(TBI)。CeONPs在损伤后1小时内按指定浓度给药。对照组接受生理盐水-柠檬酸盐。神经细胞的死亡或损伤通过损伤后24小时碘化丙啶(PrI)摄取来量化。结果以 损伤细胞/mg 蛋白的形式表达,并代表了三次重复的三个独立实验。#与未损伤培养相比差异显著,P<0.01。*与单损伤相比差异显著,P<0.01。对于b组,进行了体外TBI培养,然后用10nM CeONP 1h后(右手直条组)或盐-柠檬酸盐(左手直条组)。谷氨酸刺激下[Ca2+]i的变化被Fura-2显微分光光度计测量和成像。结果以μ±SE 表示谷氨酸刺激下[Ca2+]i的变化。来自三个独立的实验,每个实验视野下至少有50个神经元,进行两次。CeONP治疗阻断了损伤后谷氨酸刺激钙信号的干扰。*与无损伤相比差异显著,P<0.01。
在体内TBI模型研究中,如图4A所示,损伤动物的同侧和对侧与假手术组相比,过氧化氢酶活性显著下降,与TBI诱导的氧化应激损伤一致。CeONP 3×LD组与仅损伤组相比过氧化氢酶活性显著提高,而3×HD的药物又回至假手术组水平。在5×剂量组有类似结果(图4A)这种增加可能是由于大脑中CeONP的积累。如图4B所示,与假手术组相比同侧和对侧半球的总SOD活性(铜/锌、锰、铁)均显著降低。最显著为同侧半球。这些降低同样在CeONP注射后恢复。3×LD和3×HD治疗显著提高总SOD活性水平,HD使SOD活性恢复到接近假手术组的水平。在5×剂量组有类似结果。图4C显示了GSH/GSSG比率在伤后24h大幅下降。3×LD和3×HD治疗显著提高GSH/GSSG比率。HD治疗更加有效,尤其是对侧,恢复到假手术组的水平。伤后24小时CeONP使GSH/GSSG增加。5×剂量治疗恢复GSH/GSSG比率至假手术组,5×LD恢复对侧至正常,5×HD恢复双侧至正常。
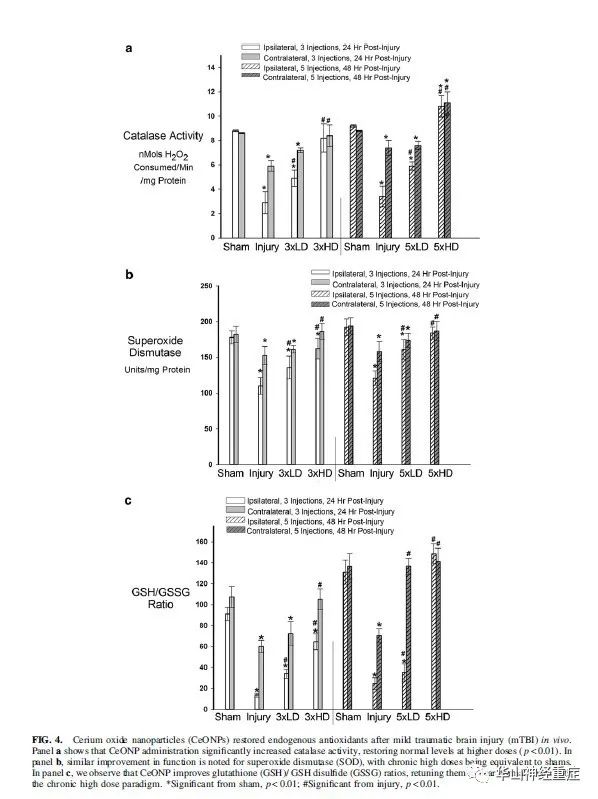
图4 氧化铈纳米颗粒(CeONPs)修复了轻度创伤性脑损伤(mTBI)体内模型的内源性抗氧化剂。a组显示CeONP给药显著增加过氧化氢酶活性,在较高剂量下恢复正常水平(p < 0.01)。在b组中,超氧化物歧化酶(SOD)的功能得到了类似的改善,慢性高剂量可等同于sham组。在c组中,我们观察到CeONP改善了谷胱甘肽(GSH)/ GSH二硫化物(GSSG)比率,以慢性高剂量模式使其恢复到接近正常水平的。*与sham相比差异显著,P<0.01。#与损伤组相比差异显著,P<0.01。
CeONPs是否可以减轻大分子物质由于过量的自由基产生而造成的损害,结果如图5A所示,与sham比较mLFPI增加损伤后24、48 h LOOH水平,表明细胞脂质的氧化损伤。三次CeONPs药物注射减缓了LOOH的增加。HD可将双侧半球将LOOH水平恢复至sham组。五次注射结果类似。NT是自由基破坏蛋白质的产物。 在mLFPI后同侧半球NT明显升高,与sham相比。24和48 h分别增加了48%和41%。(图5B)有趣的是,NT没有显著增加,发生在对侧皮质损伤。LD注射CeONP(3×、5×)未显著影响MT水平。3×HD使NT下降9%,5×HD可下降至sham水平。
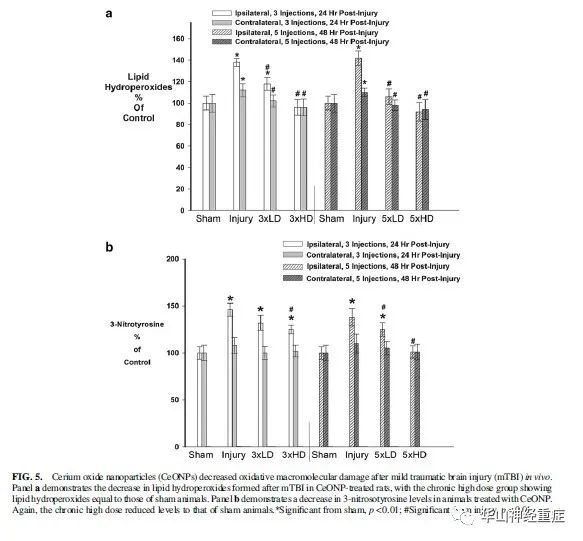
图5 氧化铈纳米颗粒(CeONPs)在体内降低了轻度创伤性脑损伤(mTBI)的氧化大分子损伤。a组显示CeONP处理的大鼠在mTBI后脂质过氧化氢含量下降,慢性高剂量组的脂质过氧化氢含量与假手术组相当。b组显示CeONP处理的动物3-亚硝基酪氨酸水平下降。同样,长期的高剂量将水平降低到假手术组的水平。*在sham中显著,p < 0.01;#在损伤组中显著,p < 0.01。
图6显示NOR测试对照小鼠的结果(左图),与接受5×HD治疗的受伤小鼠(右图)相比对各个物体的相似探索提示记忆缺失。相比之下,CeONPs处理动物表现出对新颖的对象明显增加的探索,表示完整的记忆。图7显示了不同的处理组对新奇对象的偏好计算的结果,动物接收5×LD时,与对照组相比呈现趋势改善0.5 NOR指数(p = 0.0794) ,5×HD中的动物治疗组表现出与假手术组相似的行为对新事物的偏好显著高于0.5(p = 0.0041),证明记忆力有所改善。

图6 轻度创伤性脑损伤(mTBI)改变了新对象识别测试中的对象探索。该图显示了对图7中量化的新目标识别测试的一个代表性的跟踪。黄色箭头表示新对象。跟踪中的蓝色箭头表示鼻点跟踪,而红色方块表示身体中心跟踪,紫色方块表示尾部跟踪。对照组治疗的受伤动物(左)在两个物体上花费了相似的时间,因此无法区分新奇和熟悉的物体。接受慢性大剂量氧化铈纳米颗粒(CeONPs)的动物表现出对新对象的优先调查,表明改善记忆。
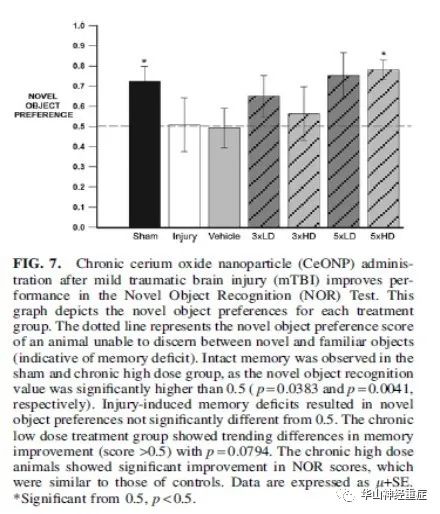
图7 慢性氧化铈纳米颗粒(CeONP)治疗轻度创伤性脑损伤(mTBI)提高了新对象识别(NOR)测试的性能。这个图表描述了每个处理组对新对象的偏好。虚线表示无法分辨新奇和熟悉物体的动物,对新奇物体的偏好得分(表明记忆缺陷)。假手术组和慢性高剂量组记忆完好,新物体识别值显著高于0.5 (p = 0.0383和p = 0.0041)。损伤性记忆缺陷导致对新物体的偏好与0.5无显著差异。慢性低剂量治疗组在记忆改善方面有逐渐的差异(分数>0.5),p = 0.0794。长期高剂量的动物在NOR评分上有显著的改善,这与对照组相似。数据以以μ±SE 表示。*与0.5相比差异显著,p < 0.5。
研究结论
本文首次证明了脑内CeONPs的作用可改善mTBI的病理结果。虽然需要更多的生化和行为学的的研究,本研究表明了mTBI新的前景疗法:一种CeONP纳米药物。
讨论
本文首次报道CeONPs降低mTBI体内和体外的生化和功能后遗症,CeONPs是有效的可再生自由基清除者和线粒体保护剂。CeONPs的抗氧化能力从这些纳米粒子的三个特性可以看出:首先,铈以+3或+4状态存在,并在这些价之间相互转化给予了其高抗氧化电位,其次,CeONPs有氧空隙或“电子空穴”进一步参与自由基的清除和自由基清除能力的再生。最后纳米级的尺寸提供自由基反应的高表面积和与水中离子的相互作用。本文通过TBI的体外模型,发现CeONPs剂量(10nm)可在轻度和中度创伤性脑损伤后减少细胞损伤和死亡。在[Ca2+]i失调实验中, 10nM剂量的CeONPs在伤后1小时使用,完全阻断了损伤后的[Ca2+]i失调作用,受损的神经元在谷氨酸的刺激下维持了正常的[Ca2+]i反应。这些观察提示使用CeONPs缓和损伤后的促氧化环境可能有助于神经信号和功能的保存。
为进一步确定CeONPs在mTBI中的疗效,本文使用体内模型研究他们缓和内源性抗氧化系统病理性减少的能力。两种注射模式显示与单纯损伤组比改善的过氧化氢酶、SOD、GSH/GSSG比值,5×HD可将其恢复至假手术组水平。但由于CeONPs在体外就有过氧化氢酶、SOD的特性,目前尚不清楚是否恢复的SOD和过氧化氢酶水平是直接来自于CeONPs,还是由CeONPs清除自由基,使内源性SOD和过氧化氢酶保存引起。考虑到本研究使用的CeONPs为低剂量,可能两种机制都存在作用。SOD,过氧化氢酶,GSH的恢复与缓和氧化诱导的大分子损伤有关,LOOG和NT水平在4×HD方案下恢复到原来水平。这些结果提示mTBI后CeONPs注射为内源性抗氧化剂防御提供支持并减少系统损耗,缓和过氧化损伤。在功能实验中,单纯受伤组可观察到记忆受损。5×HD方案作用下我们看到了上述情况的改善。CeONPs注射后动物认知功能的改善可能与氧化环境缓和后神经存活率增加有关。因此,CeONP减轻氧化应激和保持神经元功能的能力可以表现为mTBI之后的记忆改善。
一些报告提示CeONPs和其他纳米颗粒的毒性。然而,这些以前的研究中使用的剂量比本文高1000倍。在该小组最近进行的一项研究中,最多在鼠静脉给药5μg/g剂量之内,单剂量给药6月内并未发现病理和神经方面的后果。但鉴于给定的剂量在大脑中停留不被代谢,时间更长的持续研究是适当的。