神经外科监护室多重共病患者:最大限度地减少围手术期心肺并发症

2020 Aug 13.https://doi.org/10.1007/s12028-020-01072-5
随着慢性病的日益增加,多重共病患者在神经外科重症监护病房(NICU)已经司空见惯,这给管理带来了特殊的挑战。慢性共病大大增加了术后并发症的风险,尤其是心肺并发症,这些并发症最终会对神经外科治疗结局产生负面影响。所以围手术期优化很有必要,同时需要彻底的术前风险分层,对多共病患者紊乱的生理学有基本的了解,并对手术、麻醉和神经危重症监护干预措施可能会改变共病病理生理学有一个正确的认识。此综述强调了NICU围手术期的潜在隐患,描述了常见的术前风险评估工具,并讨论了NICU多共病患者的围手术期管理策略,特别强调了减少术后心肺并发症和意外再插管的方法,结果发表在2020年8月13日的Neurocrit Care上。
研究背景
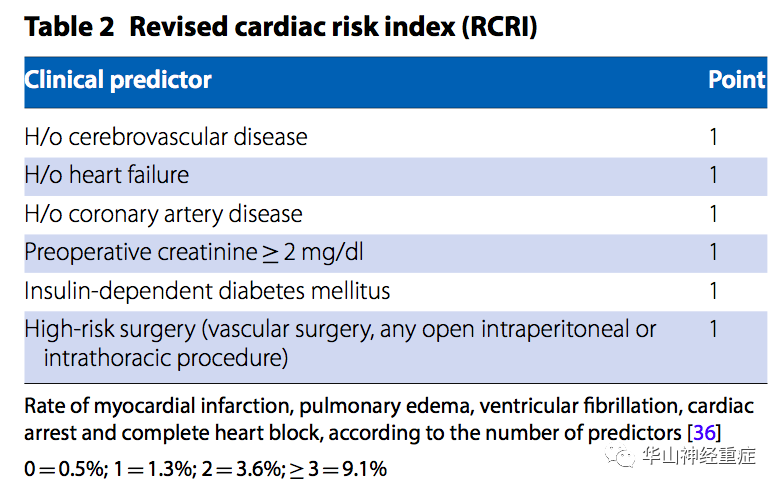
随着慢性病患病率的增加,预期寿命延长。神经外科重症监护病房(NICU)中多重共病患者越来越常见。合并慢性病降低了生理储备,从而增加了在生理应激情况下发生进展性器官衰竭的风险,如低氧血症、血压极度变化、低血容量、急性失血和交感神经活动兴奋。因此,共病的主要并发症对NICU患者围手术期监护和预后会产生不利影响。这种认识促使了早期评估患者虚弱程度和对手术治疗耐受性等进行评分,比如美国麻醉师学会身体状况(ASAPS)、修订的心脏风险指数(RCRI)、急性生理学和慢性健康评估(APACHE)评分甚至是针对合并共病的动脉瘤性蛛网膜下腔出血(SAH)患者分级系统,以改善预后预测。
了解多个合并症之间的相互作用如何对术后住院死亡率和主要并发症(特别是心肺并发症)的风险产生复合效应也是非常重要的。最近,Thomson等人回顾性地提出了术前衰弱评分来预测在接受颅神经外科手术的多共病患者中可能增加的风险。但相关研究仍比较局限。
因此,更好管理这些复杂的病人群取决于围手术期的优化和对手术、麻醉和神经危重症监护干预措施对共病病理生理学的影响。此综述回顾讨论了这些原则和NICU监护方案,旨在尽量减少术后心肺并发症。
围手术期潜在隐患
NICU患者合并慢性共病一般需要特殊关注,以便制定个体化的围手术期计划,目的是使患者生理储备不足导致的潜在医疗并发症最小化。此种评估可以指导术前医疗优化和围手术期资源的合理使用,如神经危重症监护。NICU神经外科手术病人意向性观察标准目前仍不完善,对于高危但稳定的患者,需要在围手术期入住NICU的临床路径目前尚未得到统一采用。然而,当合并多发病与复杂的神经外科手术相结合时,这些患者的挑战性需求可以通过围手术期在神经重症监护室开始的全面评估、医疗优化和密切监测得到更好的满足。事实上,根据一些回顾性研究分析了由于术前准备不足而导致的不同的手术环境,呼吸和血液动力学不稳定在手术室中的病人中并不少见,并可能导致取消择期手术或可能带来不良后果的方式进行手术。当然,管理难题的重要部分是神经外科医生、麻醉师和NICU医师之间就多重共病患者的需求进行良好的相互理解和持续沟通。
神经外科患者合并多重共病心脏风险分层的重要性,在于个体化围手术期策略,从而减少主要心脏不良事件(MACE)。
对于择期手术病人,风险评估通常由麻醉师进行。同时也来自患者的内科医师的提供,内科医生可以努力为优化医疗问题做出贡献,并应与所有相关团队进行跨学科交流。对于高危患者,NICU医师参与这项评估是有必要的,因为提供了强化和进一步检查的早期机会。随着人口老龄化和肥胖、Ⅱ型糖尿病和慢性肾脏病发病率的不断上升,意味着更多的神经外科患者可能合并缺血性心脏病和心力衰竭,从而增加MACE风险。神经外科手术可能导致严重的生理应激,通过容积变化、急性失血、氧需增加、血压波动、心率和术后血小板反应性增加,导致心肌功能不全。由于心肌受到中枢神经系统影响,颅内病变患者也可能发生心血管紊乱(血压波动、心律失常、心肌缺血和神经源性应激性心脏病)。心脏储备受损的患者对这些影响的耐受性较差。缺血性心脏病、充血性心力衰竭、胰岛素依赖性糖尿病、慢性肾脏病和脑血管病都被提示和术后不良心脏事件和死亡增加有关。ASAPS分类系统可以捕捉到这种高风险因素,ASA等级的增加与并发症的高风险相关(表1)。然而,RCRI(表2)更精确地评估了这一点,根据该工具,在心脏病发病的六个独立预测因素中,存在两个或两个以上的危险因素与MACE的风险升高相关。此外,使用国家外科质量改进计划(NSQIP)数据库开发了一个经过充分验证的在线手术风险计算器,可以更准确地估计心脏风险,以及预测其他围手术期共病疾病和死亡率。在最近Quinn等人的一项大型回顾性研究中,利用上述数据库来探讨非创伤性急诊和择期开颅手术和脊柱手术中心脏骤停(CA)的发生率,发现ASA等级>3、慢性肾脏疾病或充血性心力衰竭的患者发生CA的风险增加。此外,经历CA的患者更容易发生额外的术后不良反应,如急性肾损伤、透析、机械通气失败、心肌梗死、静脉血栓栓塞和败血症。因此,作者认为,通过这些NSQIP数据对患者和手术特殊性的临床洞察可以促进旨在降低神经外科患者群体发病率和死亡率的治疗措施。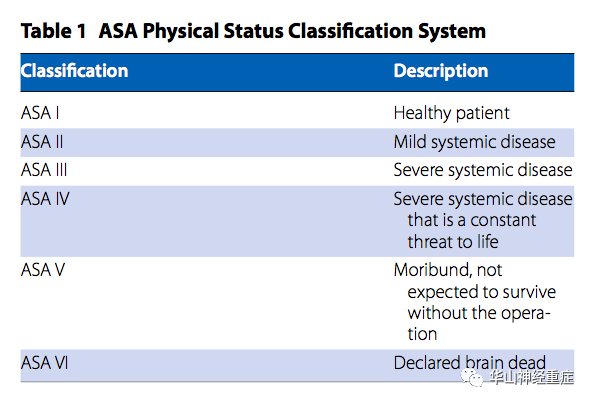
加强围手术期管理降低心脏病风险
持续性心动过速、贫血和血压极度变化等因素会增加心肌缺血的风险,这一认识决定了围手术期的NICU监护包括积极的疼痛管理、严格的血压控制和血流动力学优化作为标准方法。更具争议的问题是围手术期使用β受体阻滞剂和血管紧张素转换酶抑制剂/血管紧张素II受体阻滞剂(ACEIs/ARBs)以及这些针对高危患者的最佳输血阈值。随机对照试验(RCT)的荟萃分析发现,当在非心脏手术后24小时内重新开始β受体阻滞剂时,死亡率和缺血性中风有可能增加,这可能是由于β受体阻滞剂的低血压以及对脑血管扩张作用的潜在干扰。特别是,POISE研究(一项多中心安慰剂对照试验,对接受中、高危手术的患者,RCRI至少为1)得出结论,室上性心律失常和急性心肌梗死的显著减少是以围手术期低血压为代价的,并且被30天卒中和全因死亡率的显著增加所抵消。这些发现表明,围手术期慎重选择β-受体阻滞剂是最重要的,尤其是当预计会有大的手术失血时。毫无疑问,术前停止慢性β-受体阻滞剂治疗可能导致较差的结果,因此也是不明智的。然而,同样有害的是对无明显适应症的非心脏手术患者不加区分的β-受体阻滞剂治疗。大多数入选的患者的RCRI为1或2,但观察研究和回顾性分析表明,围手术期β受体阻滞剂可能只对RCRI≥3的患者有益,并增加RCRI为0的患者的死亡几率。根据这一证据和ACC/AHA指南中的建议,可以得出以下结论:(1)β受体阻滞剂应该在已经接受β受体阻滞剂的患者中继续使用,并且(2)只有在术前风险评估确定≥3个RCRI危险因素的患者才开始围手术期β受体阻滞剂是合理的。然而,在后一种情况下,立即重新启动β受体阻滞剂仍然存在争议,鉴于上述危害风险,一般应避免。相反,只要病人的血液动力学稳定,术后也可以考虑滴定法使用药物。在这种情况下,建议咨询心脏病专家,以获得更优化的方案。关于ACEIs/ARBs的围手术期处理存在争议,ACEIs/ARBs是高危外科患者最常用的抗高血压药物。目前ACC/AHA指南为非心脏手术中持续ACEIs/ARB提供了IIa级建议。然而,一项大型国际前瞻性队列研究表明,在主要非心脏手术前24小时内停止ACEIs/ARB与较低的死亡风险、术中低血压、术后卒中或心肌损伤相关。尽管如此,在确认术中低血压风险的同时,2018年的荟萃分析未能证明围手术期应用ACEIs/ARBs与死亡率或MACE之间的关联。需要进行一次大规模的随机试验来阐明这个问题。在此期间,对大多数患者来说,术前24小时停用ACEIs/ARBs是合理的(尤其是当预计会有大量液体转移时),但术后及时恢复(最好在48小时内)对于降低术后MACE风险和死亡率非常重要。
维持氧供需平衡需要适当治疗贫血。大多数普通ICU队列的研究支持限制性输血阈值为7 g/dl,但仍缺乏指导神经外科患者实践的确凿证据。
贫血与非心脏手术后术后死亡率的增加以及急性脑损伤后更差的预后相关,但输血也是如此,这似乎与增加院内死亡率、感染、脑血管痉挛、神经外科患者大脑自动调节恶化和其他不良事件的风险平行。这些不良结果的机制与红细胞(RBC)随着冷冻血液(储存长达42天)老化而发生的一系列变化有关,统称为“红细胞贮存损伤”,包括:(1)红细胞内能量来源的减少和膜结构的改变,导致红细胞变形能力受损和脆性增加,后者会导致分解产物的释放,从而诱发促氧化剂、细胞毒性和一氧化氮(NO)的消耗量增加;(2)2,3-二磷酸甘油酸(DPG)水平降低,其通过将氧血红蛋白离解曲线向左移动来减少组织氧传递;(3)血液中NO合酶活性降低,这可能通过降低NO的生物利用度而导致微血管穿孔。然而,文献中关于输血的不良结果的发现并不一致;此外,相关研究的方法论缺陷使得人们很难将贫血和输血的有害因素与潜在疾病的严重程度相分离。
因此,神经外科患者理想的输血策略仍然是一个临床难题,鼓励进行个体化风险效益分析。对随机对照试验的系统回顾显示,随机分配到限制性阈值的心血管疾病患者发生急性冠状动脉综合征的风险增加,从而表明该组更宽松的输血策略(>9g/dl)的益处。此外,在一项对非心脏手术患者的回顾性研究中,血红蛋白下降超过术前值35%的急性手术性贫血增加了MACE的风险,尤其是在β受体阻断的患者中,这表明这类患者的输血阈值应该更高。
精确的血液动力学监测和管理,以防止低血容量和高血容量,对于维持SAH后血管痉挛患者足够的脑血流量(CBF)和减少系统并发症是非常重要的。无论是不充分或过度积极的静脉液体给药都可能导致迟发性脑缺血(DCI)或心肺并发症的增加和死亡率增加。这些考虑尤其适用于心脏储备不足或肾损害的多共病神经外科患者,即使是适度的预负荷增强后,也有发展或加重肺水肿的风险。监测CO也可以更好地指导避免脑灌注不足。事实上,Drummond最近的一篇社论强调了在生理应激的特殊情况下可能存在的CO-CBF直接连接,认为低CO的治疗改善可能会刺激脑血管扩张的机制(例如,颈交感神经链的输出减少,提供大脑颅外和近端颅内血管的血管收缩神经支配;内皮细胞释放NO以响应动脉搏动的增加)。尽管这些机制的生理学证据有限且未被广泛承认,但关于这些机制的可用生理学证据已经足够清楚,作者认为,在CO减少的情况下,通过血管加压素增加MAP可能会通过CO的额外减少而进一步损害CBF,这会促进上述症状介导的脑血管收缩。在这种情况下,与肌动蛋白共同修复将是一种更健康的CBF保存方法。几种可用的微创先进血流动力学监测系统(如PiCCO、LiDCO、FloTrac/Vigileo和VolumeView/EV1000)可连续评估CO和容积反应性,避免使用肺动脉导管(PAC)进行测定的不足和伴随的风险。这些设备需要插入动脉导管,以便逐拍分析动脉脉压波形的轮廓,然后与每博量变异相关。(SV:与动脉波形收缩部分曲线下面积成比例)。其中一些方法(PiCCO、VolumeView/EV1000)允许通过间歇性经肺热稀释(TTD)测量CO来校准脉搏轮廓分析。非自动化过程需要一个中心静脉导管(CVC),用于冷盐水注射,并插入带有热敏电阻的中央动脉导管,它可以记录主动脉压波形并感觉到冷盐水注射后体温的下降。有证据表明,TTD测量值与PAC测量的绝对CO值(PATDCO)有很好的对比,其基本区别在于,PATDCO的血液温度变化由位于PA的热敏电阻记录,与TTD曲线相比,峰值更早、更高。TTD还允许确定特定的胸腔内病理生理学意义上的体积变量。通过经肺锂稀释技术(即LiDCO系统,根据注入的最小剂量的锂和再循环前浓度-时间曲线下的面积)是一种替代策略,不需要CVC或专门的中心动脉导管,但不计算上述胸腔内容积变量。其他有用的参数包括每搏量变异(SVV)、脉压变异(PPV)、舒张末期容积指数(GEDVI,正常范围680–800 ml/m2)和血管外肺水指数(EVLWI,正常范围3–7 ml/kg)。SVV和PPV(SV和PP的变化百分比,分别对应于单个机械呼吸循环中的预负荷变化)已被证明比心室前负荷的静态指标(如中心静脉压(CVP)和肺动脉阻塞压力)更好地预测液体反应性。在受控机械通气条件下,SVV和PPV是患者在Frank–Starling曲线上位置的动态反映,可以可靠地预测预负荷反应性,前提是患者的通气量至少为8 ml/kg,而不是自发呼吸,右心室功能正常,无心律失常。低SVV或PPV表现在曲线的平坦部分,表明SV对机械吸气引起的预负荷循环变化不敏感,因此缺乏液体反应性。相反,较大的SVV或PPV表明患者在陡峭的曲线上运行,因此液体反应灵敏。GEDVI和EVLWI是由TTD测量的体积变量。GEDVI是心脏前负荷的静态指标,代表四个心腔舒张末期的总容积。然而,它没有区分左、右心前负荷:在右心室扩张的情况下,面对正常的左心室前负荷,GEDV可能增加。EVLWI提供了肺部存在的水量,使其成为监测肺水肿发生和发展的有用参数。这些变量的治疗阈值是不均匀的,但一般来说,SVV>10%、PPV>13%或GEDVI<680 ml/m是液体反应性的预测因子;SVV<10%和PPV<13%表明缺乏液体反应;GEDV>921 ml/m2和EVLW>10 ml/kg代表肺水肿的警告参数。由于神经外科患者在麻醉过程中常因吸入性麻醉剂和血管扩张剂而发生明显的血管内容积变化,因此,这些工具已用于颅内手术的术前和术中液体优化。此外,对SAH患者进行了术后研究。在一项100例连续性蛛网膜下腔出血病例的前瞻性随机试验中,接受PiCCOplus系统指导的早期靶向血液动力学治疗的患者与传统的CVC或PAC引导下的预负荷测量进行比较,其TCD血管痉挛、DCI、肺水肿和心律失常的发生率降低。在一项用PiCCO系统监测的180例SAH患者的多中心前瞻性观察研究中,SAH后第一周内GEDVI<822ml/m2与DCI的相关性最好,这表明维持GEDVI略高于正常水平可以减少这种并发症。相反,大于921ml/m2的数值与严重肺水肿的相关性最强。此外,一项对10名连续的低级别SAH患者进行的单中心前瞻性观察研究表明,脑组织氧压改善和CI增加之间存在密切关系,SVV≥9%。这一证据表明,通过这些工具进行目标导向的血液动力学管理,对于改善伴有血管痉挛的蛛网膜下腔出血患者的功能预后具有治疗上的优势,并减少心、肾功能较差的神经外科患者因容量超负荷而引起的心肺并发症。然而,所有脉冲轮廓分析会有潜在误差源和临床局限性(表3)。同样重要的是要记住,SSV和PPV不是容积状态的指示器,而是Frank–Starling曲线上位置的动态标记,反射了左心室对预载变化的反应性。然而,这种曲线的斜率取决于变向性和后负荷,这决定了低压性能。对于给定的左心室前负荷,肌力降低或后负荷增加(血管加压素)会降低Frank–Star-ling曲线的斜率(即,降低左心室的性能),从而降低SV,从而降低SVV和PPV。相反,增加肌力(肌力)或减少后负荷(如败血症、血管扩张剂)会增加斜率(改善左心室功能),从而导致更大的SV、SVV和PPV。血管加压素还可以通过增加细胞张力来降低SVV和PPV的大小(从而掩盖真正的血管内容量),从而通过将血液从非压力状态转移到压力容量来增强静脉回流(从而增加SV。血管扩张剂通过增加无应力循环血容量来降低SVV和PPV,从而形成相对低血容量状态。这意味着肌力或血管舒缩张力的显著变化可以独立于真实的容积状态影响PPV和SVV,可能导致对液体管理的这些指标的误解。例如,在SVV和PPV的理想cutoff值指导下的液体治疗可能导致收缩力增加或后负荷减少的患者出现容量过载,而在收缩力下降或血管加压素引起的后负荷和毒细胞张力增加的患者中,可能导致隐性低血容量。在感染性休克早期或明显失血/失血的情况下,不应根据这些动态指标来决定是否使用液体(液体给药明显有益),只有当认识到上述混杂的相互作用可能阻碍这些变量指示血管内容积变化的能力时,SVV和PPV才能恰当地指导初次复苏后进一步容积扩张的需要。此外,即使检测到预负荷反应性,液体给药的决定也不应是自动的,而是基于风险-效益分析,考虑到液体过载的高风险和组织低灌注/缺氧的存在。因此,重要的是实施一种深思熟虑的方法,将容量反应性的CO和动态指数与器官灌注的“下游”标记物(如静脉血氧饱和度、乳酸、毛细血管阻力和肌钙蛋白)相结合,从而更好地反映复苏的需要和充分性。

多重共病患者术后肺部并发症
神经外科合并多重慢性病患者术后肺部并发症(PPC:肺不张、肺炎、肺栓塞、术后呼吸抑制和长时间机械通气)的风险增加,这些并发症是发病率和死亡率的重要来源。尤其是COPD,在所有研究中成为PPCs最一致的预测因子:COPD患者对镇静剂、阿片类药物和残余麻醉剂的呼吸抑制药物更为敏感,这增加了他们意外插管的风险。此外,术前插管时支气管痉挛加剧,慢性细菌性气道结缔组织和手术诱导的免疫抑制都可能促进肺部感染和急性呼吸衰竭。慢性阻塞性肺病患者也倾向于同时患有冠心病和充血性心力衰竭,肺水肿的风险增加。最后,表现出致命性肺栓塞的倾向性增加。
同样,病态肥胖神经外科患者术后呼吸功能障碍、拔管失败和呼吸机脱机困难的风险显著增加。神经重症医师必须牢记这些患者呼吸力学的改变,胸壁顺应性降低与胸壁、膈肌和腹部的大量肥胖有关,这限制了胸壁的活动性和膈肌向腹腔的偏移。这种变化可通过以下方式加剧:仰卧或俯卧姿势,这使得腹部巨大的腔室压力升高,使膈肌向上移位,从而降低了胸腔的容量;术后疼痛,导致通气受限;全身麻醉和残余麻醉药物,导致膈肌张力丧失,腹内压无对抗性;服用镇静剂或阿片类药物。此紊乱的生理学会导致肺容量、特定功能性残余容量(FRC)和呼气储备容量(ERV)的减少,进而使肥胖患者容易发生:1)基底肺区域的肺不张(由于FRC在闭合容量范围内,肺泡和小气道塌陷),随后出现通气-灌注(V/Q)不匹配(肥胖患者低氧血症的常见原因);(2)呼气时气道阻力增加,由于早期气道关闭,导致气流受限(EFL),从而导致空气潴留,从而提高固有的呼气末正压(“内源PEEP”);以及(3)增加呼吸功,因为吸气肌承受着克服胸壁顺应性降低内源PEEP的任务。在这方面,必须强调的是,为了促进膈肌偏移和防止呼气流速限制,不应允许自发呼吸的病态肥胖患者完全平躺。相反地,反向特伦德伦伯格氏卧位可以从横膈膜上“卸下”腹部内容物的重量,从而增加胸部顺应性、FRC和氧合。肥胖患者还表现出较高的阻塞性睡眠呼吸暂停(OSA)的发生率,这是意外重新插管的另一个危险因素。即使是最低浓度的残余麻醉剂,或低剂量的镇静剂和阿片类镇痛剂也可能通过降低咽部肌肉张力(通过舌下神经减少神经输入)和减弱呼吸和唤醒对高碳酸血症、缺氧和上气道阻塞的反应而恶化。
减少神经外科肥胖或慢性阻塞性肺病患者术后再插管的风险有几种策略有可能将病态肥胖和/或慢性阻塞性肺病患者意外再插管的高风险降至最低,这反过来又与较高的死亡率、更长的ICU疗程、医院获得性肺炎的发病率以及转移到长期护理机构的风险增加相关。术后即刻应进行激励性肺活量测定和积极的胸部理疗。此外,避免使用苯二氮卓和尽量减少长效阿片类药物是降低呼吸抑制风险的重要因素。尽管合理使用阿片类药物仍然是神经外科术后疼痛管理的主要手段,但依赖于非阿片类药物的多模式镇痛镇静,如对乙酰氨基酚、右美托咪定、氯胺酮和加巴喷丁类药物,应大力考虑将这些高危患者对阿片类药物的需求降至最低,最好与疼痛专家合作实施。尤其是右美托咪定(α2-肾上腺素能受体激动剂)是一种吸引人的药物,因为它具有诱导镇静和镇痛的特性,而不会引起明显的呼吸抑制或呼吸阻塞;以及它对交感神经的作用可以帮助维持稳定的血压和心率。氯胺酮(非竞争性NMDA拮抗剂)由于其阿片类药物的作用,在ICU安乃近镇静方案中也可能占有一席之地,特别适用于患有慢性疼痛和阿片依赖的患者,这些患者同时需要接受大型脊柱手术。加巴喷丁类药物是脊柱大手术患者的另一种选择,因为其能阻断钙通道,而钙通道在脊神经节上调,并导致神经性疼痛。其也可能具有抗焦虑特性,降低术后焦虑评分。然而,值得注意的是,根据一些病例报告和两项随机试验,加巴喷丁类药物与中枢神经系统抑制剂(如阿片类药物、苯二氮卓类药物、抗抑郁药、抗精神病药和抗组胺药)联用或者用于COPD和老年患者时,会引起呼吸抑制。对于这些高危患者,可考虑的其他阿片类药物预防策略包括:(1)在开颅手术切口前使用局部麻醉剂(如利多卡因)进行局部头皮阻滞,布比卡因或罗哌卡因;(2)硬膜外/全麻复合麻醉和术后硬膜外镇痛在脊柱大手术患者中的应用。根据一项前瞻性随机研究,与术后阿片类镇痛的常规全麻相比,后一种方法可能会更好镇痛、引起更少的出血和更低的手术应激反应。然而,这一战略并没有被广泛采用。此外,考虑到交感神经阻滞的潜在重要副作用,接受硬膜外镇痛的患者需要在与疼痛专家协商后进行密切的术后监测和管理。几位作者还记录了在拔管后立即预防性应用持续气道正压(CPAP)或无创通气(NIV)的益处,以将高危患者再次插管的风险降至最低。神经外科文献中缺乏关于术后实施无创通气支持(作为近期拔管患者的预防措施)的证据;然而,这一策略得到了随机试验和荟萃分析的支持,这些试验和荟萃分析检查了其在其他各种外科手术中的应用,如果在拔管后不久和呼吸衰竭开始前应用,记录改善动脉血气、降低再插管率和降低死亡率。相比之下,NIV似乎有助于减少再次插管的需要,如果延迟到拔管后呼吸衰竭发生后才进行,则可能有害。根据随机对照试验和荟萃分析,拔管后经鼻高流量氧疗(HFNC)可以高达60l/min的速率输送热氧和湿氧,是降低低氧性呼吸衰竭高危患者再插管率的可靠替代方法。在适当选择的患者中,HFNC可考虑避免使用NIV可能带来的潜在问题,如皮肤损伤、眼睛刺激、界面不耐受、饮食和排痰中断。HFNC降低再插管率的机制包括:(1)在咽部产生低PEEP水平(2.7-7.4cmH2O,基于流速、鼻尖大小和嘴的位置),这可以减少气道塌陷,维持肺泡的换气,改善通气-灌注不匹配;(2) 提供高达100%的恒定吸入氧气浓度的能力,同时还提供气道的热湿化,提高舒适度,促进分泌物清除;(3)与咽部死腔的二氧化碳冲洗有关的呼吸工作减少,由于HFNC通过高含氧量在咽部形成一个氧气库;这会减少二氧化碳的再呼吸,从而提高通气效率。然而,作为持续气道正压的一种形式,HFNO与NIV具有某些潜在的禁忌症,包括颅底骨折或手术以及最近的经蝶手术,这些压力的传递可能导致手术修复失败或出现气颅。肥胖患者的机械通气:优化体位、高PEEP、小潮气量、靶向平台压力与极度肥胖相关的紊乱的呼吸力学对神经外科患者在需要时延长机械通气有重要意义。他们容易导致气流受限(EFL)、内源PEEP增加和基底部肺不张,并常伴有肥胖-低通气综合征,这些都对维持足够的氧合和从机械通气脱机的都带来了挑战。由于反向特伦德伦伯格氏卧位(与仰卧位相反)已被证明能改善呼吸系统顺应性,因此可以推断,通气血流动力学稳定,病态肥胖患者处于这种体位可能是一种成功策略的一部分,目的在于减少呼吸功,促进机械通气脱机。这种姿势的一种改进方法同样可以改善呼吸力学,即将床的上半部分抬高70°,同时保持患者背部挺直,臀部靠在床背上。与仰卧位相比,肥胖患者需要有创性机械通气时,这种姿势可以部分或完全逆转EFL,从而减少内源PEEP。应用高PEEP(10 cm H2O)预防小气道和肺泡塌陷引起的基底部肺不张,已发现病态肥胖患者与非肥胖受试者相比,呼吸顺应性、吸气阻力和氧合性明显改善。最后,在肺保护性通气的时代,建议使用低潮气量和靶向平台压力<30 cm H2O,以尽量减少通气诱导的肺损伤(VILI),这一损伤在局部肺过度扩张中起关键作用。由于过度肥胖患者的胸部顺应性降低,因此应谨慎考虑压力峰值:高值并不一定意味着肺泡过度膨胀,因为这些患者的胸膜压力升高导致经肺动脉压降低。当对病态肥胖患者使用肺保护静脉时,在某些情况下,35–40 cm H2O的平台压力可能是可以接受的。监测肺动脉压的一个选择是通过使用食管球囊技术(食管压力监测)间接测量经肺压,这可以帮助重症监护医生优化呼吸机策略,以减少肥胖患者的VILI。
结论
神经外科合并多种疾病患者的监护管理通常是具有挑战性的,但对其共病和生理病理学的透彻了解使神经危重病护理团队能够最大限度地减少和适当地处理主要的围手术期血液动力学和心肺并发症。 |
对于有三个或三个以上RCRI因子的神经外科患者,术后应考虑使用β受体阻滞剂,以减少围手术期心肌缺血和心脏死亡的风险。输血阈值仍然是没有统一定论的;然而,更宽松的血红蛋白阈值可能有利于有心血管病史的神经外科患者。 |
一些先进的微创血流动力学监测系统可能有助于指导神经外科患者的精准容量管理,因为这些患者因过度使用液体而容易发生急性肺水肿,尤其是在脑血管痉挛治疗期间。 |
有许多策略可以降低高危人群意外再插管的风险,例如(1)病态肥胖患者避免仰卧位和使用反向特伦德伦伯格氏卧位(2)拔管后立即应用NIV或HFNC(在未接受正压训练的选定患者中)(3)对肥胖或慢性阻塞性肺疾病患者实施阿片类药物多模式镇痛。 |
此外,在机械通气的病态肥胖患者中,更高的PEEP(10 cm H2O)有助于减少基底部肺不张。 |
神经外科和神经危重症护理团队之间的频繁沟通对于为多重共病神经外科患者提供最佳监护及治疗至关重要。 |

汪美华,毕业于上海交通大学,复旦大学附属华山医院神经重症医师,目前在胡锦教授团队里从事高血压脑出血、脑血管病及神经重症相关的临床和科研工作。
 亚专科
亚专科